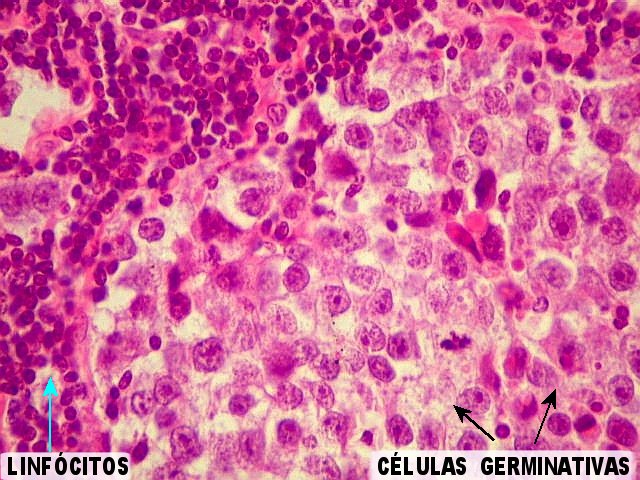
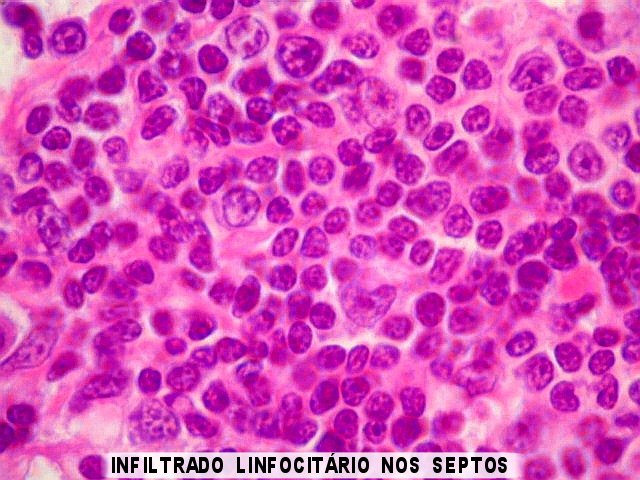
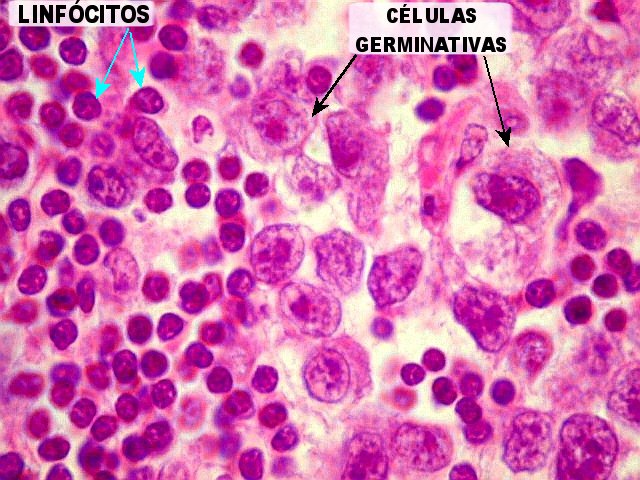
Germinoma com as feições histológicas clássicas. Em aumento fraco, o tumor tem arquitetura lobulada. Os lóbulos são compostos por células maiores e mais claras (células germinativas) e, nos septos entre eles, notam-se células pequenas e escuras que, por imunohistoquímica, mostram ser linfócitos (ver outro caso). Há ainda concreções calcáreas já existentes na pineal antes do aparecimento do tumor. | Arquitetura geral do tumor |
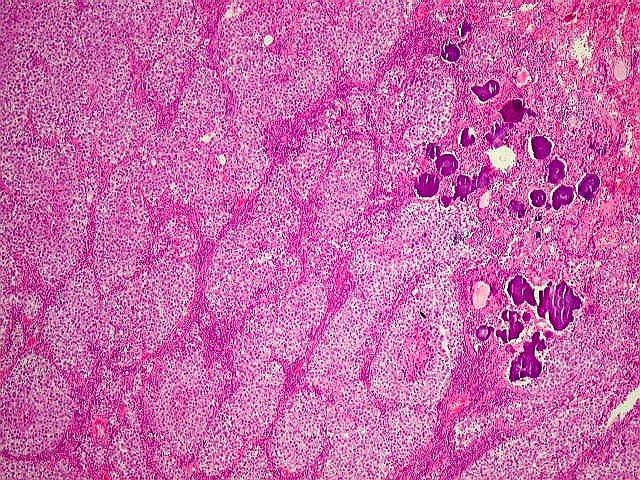 |
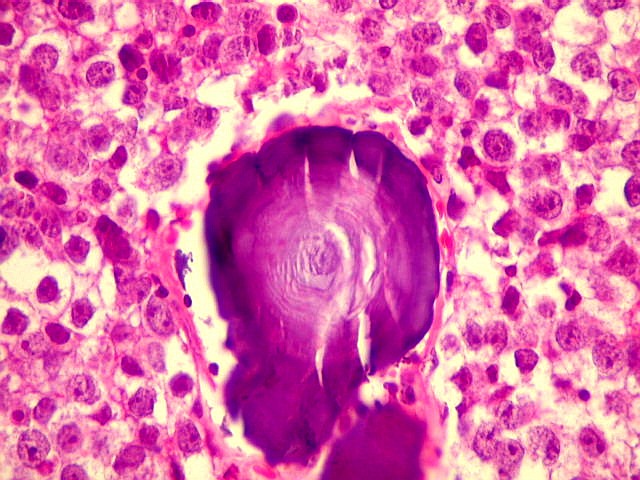
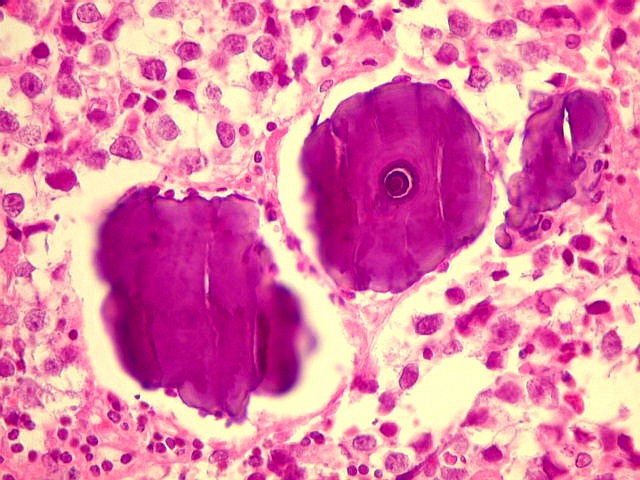
| Concreções calcáreas. Estão concentradas em certa área do corte. Em várias, observa-se a característica estrutura em camadas concêntricas, também observada na pineal normal. |
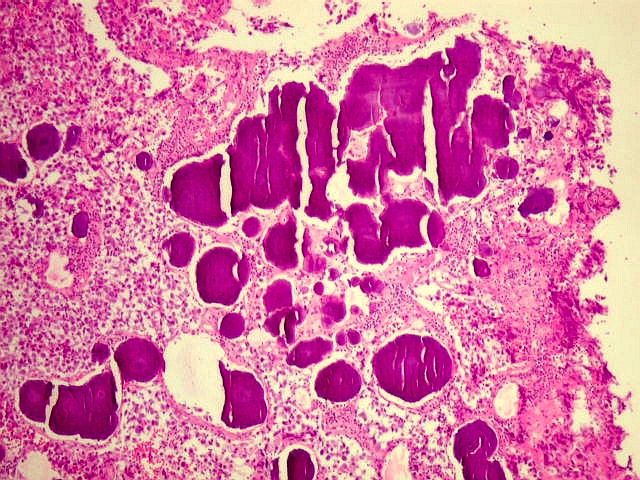 | 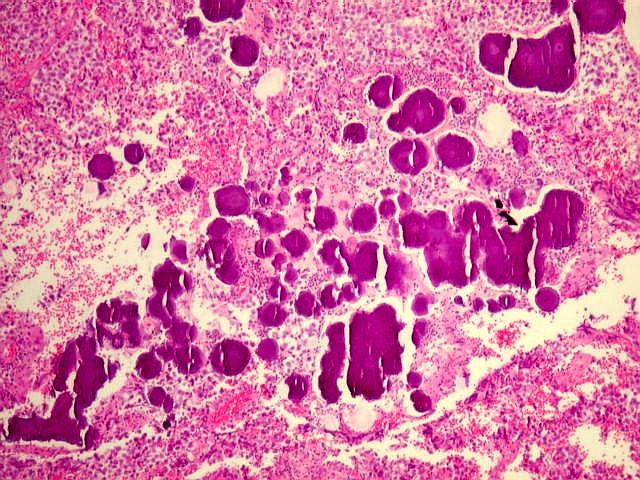 |
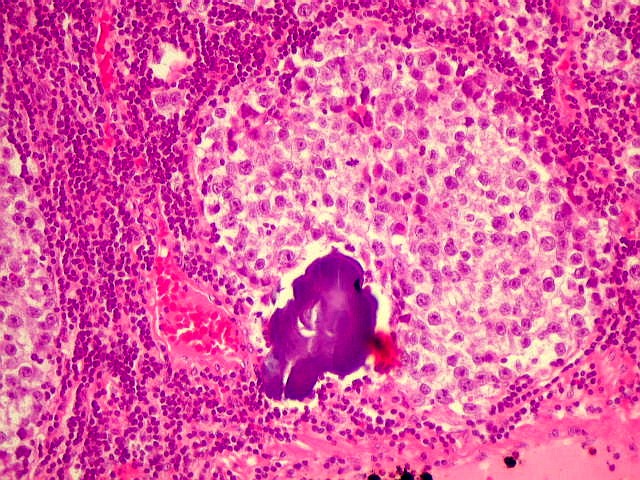 | 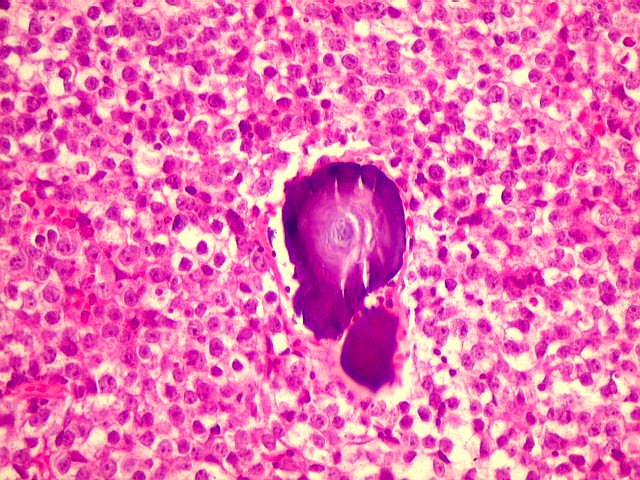 |
 |  |
|
|
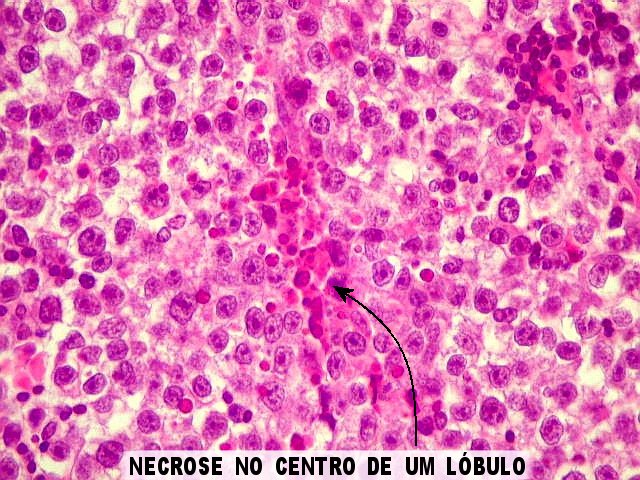
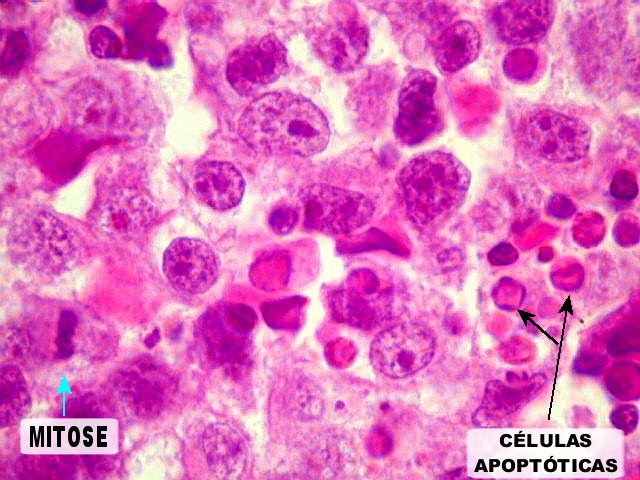
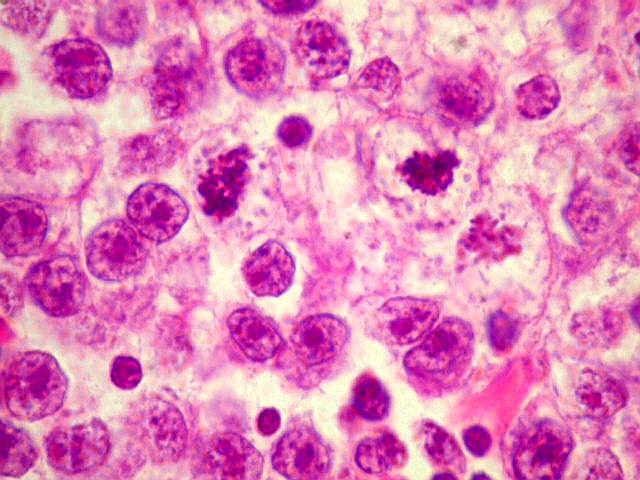
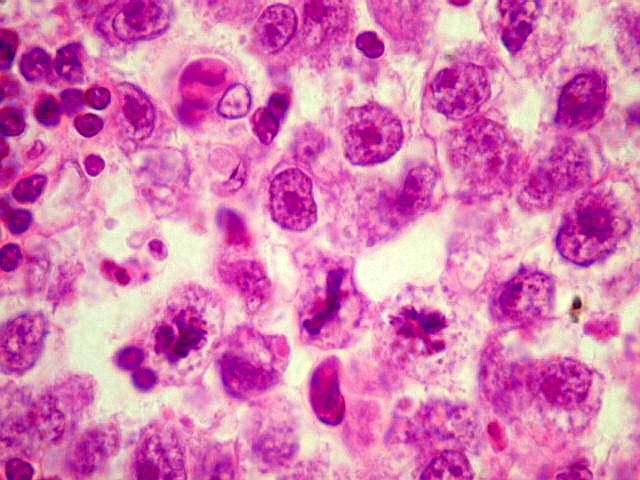
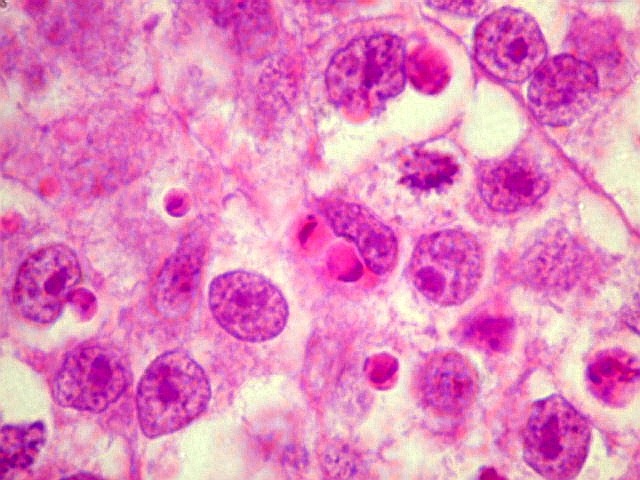
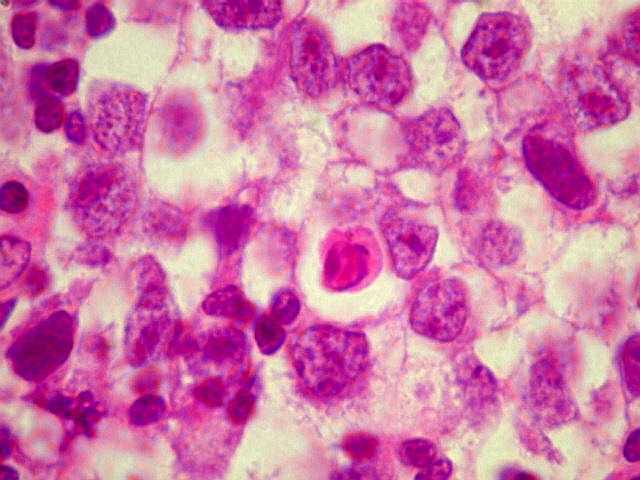
| Atividade mitótica, apoptose, necrose. |
 |  |
 |  |
 |  |
|
|
TUMORES DE CÉLULAS GERMINATIVAS
São tumores raros que afetam principalmente crianças e adolescentes. Sua morfologia e comportamento biológico são semelhantes aos dos tumores homólogos originados nas gônadas e sítios extragonadais (região sacrococcígea, mediastino). As neoplasias freqüentemente têm feições mistas de mais de uma
entidade. São elas: germinoma, carcinoma embrionário, tumor do saco vitelino (ou do seio endodérmico), coriocarcinoma, teratoma maduro, imaturo e com transformação maligna, e tumores mistos.
Incidência. No Ocidente, constituem só 0.3 a 0.5% dos tumores intracranianos primários, sendo 3% dos encontrados em crianças e adolescentes. Na Ásia são mais prevalentes (2% dos tumores intracranianos primários; 9-15% dos casos pediátricos no Japão e Taiwan).
Idade e sexo. Cerca de 90% afetam pacientes abaixo dos 20 anos. Pico entre 10 e 12 anos. 68% dos casos histologicamente verificados ocorreram na 2a. década. Há exemplos congênitos, geralmente teratomas ou tumores mistos com componente teratomatoso proeminente. Só 2% ocorrem depois dos 30 anos. A preferência masculina é 2-2,5:1 (para germinomas 1,5-2:1; para tumores não germinomatosos chega a 3:1).
Localização. Preferência por estruturas próximas da linha média. 80% ou mais originam-se na região do IIIº ventrículo: a região pineal é a origem mais comum, seguida pelo compartimento supraselar. Pode haver envolvimento simultâneo ou seqüencial das regiões pineal e supraselar.
Clínica. Tumores da pineal comprimem o aqueduto, dando hidrocefalia, e a placa quadrigêmea, dando síndrome de Parinaud (paralisia do olhar para cima e da convergência). Tumores da região supraselar comprimem o quiasma dando defeitos de campo visual, e afetam o eixo hipotálamo-hipofisário dando diabetes insipidus, retardo de crescimento e da maturação sexual. Podem também causar puberdade precoce por destruição da pineal ou do hipotálamo (o que libera as gônadas imaturas de controles inibitórios tônicos) ou por elaboração de gonadotrofina coriônica humana (HCG), um estimulante da produção de testosterona secretada por sinciciotrofoblastos imaturos. Este mecanismo explicaria casos de desenvolvimento sexual precoce em meninos, que são a grande maioria. No caso de meninas (muito mais raros), admite-se expressão pelo tumor da enzima citocromo P450 aromatase, que catalisa a conversão de C19 esteróides a estrógenos.
Imagem. Em TC, tumores germinativos não teratomatosos geralmente aparecem como massas sólidas, iso- ou hiperdensas e com forte captação de contraste. O diagnóstico de germinoma é sugerido quando o tumor contém uma glândula pineal no seu interior (evidenciada por um cluster de microcalcificações). Já tumores do parênquima pineal causam uma dispersão (explosão) das calcificações a medida que expandem e obliteram a pineal. Teratomas contêm cistos misturados com regiões calcificadas e focos com a atenuação de sinal característica de gordura. Hemorragias intratumorais são próprias de coriocarcinoma ou de tumores mistos com elementos coriocarcinomatosos.
Líquor. Pesquisa de certas proteínas no soro ou no líquor é de grande valia no diagnóstico pré-operatório e para monitorar tratamento. Os marcadores mais úteis são:
1) alfa-fetoproteína (AFP), normalmente sintetizada pela endoderme do saco vitelínico, por hepatócitos fetais e epitélio intestinal embrionário.
2) beta-gonadotrofina coriônica humana (b-HCG), uma glicoproteína normalmente secretada por sinciciotrofoblastos.
3) fosfatase alcalina placentária (PLAP), uma glicoproteína de superfície elaborada por sinciciotrofoblastos e por células germinativas primordiais.
Elevação de qualquer destes marcadores é evidência forte de que uma massa cerebral é um tumor germinativo, e o padrão da elevação ajuda prever o tipo histológico. P. ex., elevação de AFP é geralmente restrita a tumor do saco vitelínico e teratomas com elementos glandulares do tipo entérico. Elevação de b-HCG é característica de tumores germinativos compostos no todo ou em parte de coriocarcinoma. Pode também ocorrer em tumores, inclusive germinomas, que tenham as células gigantes do sinciciotrofoblasto produtoras de HCG, mesmo na ausência do citotrofoblasto, que é o outro elemento para definir um coriocarcinoma. Elevação isolada de PLAP é mais sugestiva de um germinoma puro. Quando há discordância entre o tipo de tumor esperado com base nos marcadores e a morfologia observada no material cirúrgico deve-se considerar a possibilidade de remoção incompleta, pois estes tumores são de difícil acesso.
Macroscopia. Germinoma é um tumor sólido, mole e friável. Geralmente não há necrose ou hemorragia abundantes; quando presentes sugerem componentes mais virulentos, como coriocarcinoma, que é especialmente propenso a necrose hemorrágica. Tumores do saco vitelínico caracterizam-se por acúmulo de material gelatinoso ou mixóide. Teratomas têm cistos preenchidos por muco, nódulos condróides, espículas ósseas, cabelos e dentes.
Relações entre os tumores de células germinativas. A célula germinativa pode originar o disgerminoma (quando não há nenhuma diferenciação) ou o carcinoma embrionário. O carcinoma embrionário pode diferenciar-se em três direções: para tecidos extraembrionários - origina o tumor do seio endodérmico (ou do saco vitelínico); para tecidos embrionários - origina os teratomas; ou para trofoblasto - origina o coriocarcinoma.
Microscopia. Tumores germinativos são freqüentemente uma mistura de vários tipos. Só os germinomas e os teratomas costumam ser encontrados como tumores puros. Se há vários componentes, deve-se enumerá-los e dar a proporção aproximada de cada um.
Germinoma. É o tumor germinativo mais comum, constituído por grandes células indiferenciadas que lembram elementos germinativos primitivos. As células dispõem-se em arranjo sólido ou formam lóbulos, cordões e trabéculas. Os núcleos são grandes, redondos, vesiculosos, centrais, com nucléolo proeminente. O citoplasma é abundante, claro devido a acúmulo de glicogênio. Mitoses são comuns, mas necrose não é. Há septos fibrovasculares, tipicamente infiltrados por pequenos linfócitos, principalmente T, tanto do tipo helper/inducer como cytotoxic/suppressor. A identificação desta população bifásica de pequenos linfócitos maduros e células grandes do germinoma ajuda o diagnóstico, inclusive em esfregaços. Pode também haver reação granulomatosa, que pode confundir o diagnóstico, levantando hipóteses de tuberculose e sarcoidose. A imunohistoquímica dos germinomas mostra marcação para PLAP na membrana plasmática ou, menos comumente, no citoplasma. Pode ser difícil de demonstrar em exemplos inflamatórios ou que foram congelados. Citoqueratinas geralmente são negativas (alguns tumores podem expressá-las, focalmente). Alguns germinomas contêm células gigantes do tipo sinciciotrofoblasto que se coram para b-HCG, human placental lactogen (HPL) e citoqueratinas. Ainda não se conhece a importância clínica deste achado, porém germinomas com elementos de sinciciotrofoblasto não têm a virulência dos coriocarcinomas.
Teratomas. Podem conter apenas tecidos diferenciados (teratoma diferenciado), mas a grande maioria contém tecidos menos diferenciados, lembrando componentes fetais. Sua presença, mesmo em pequenas proporções, obriga classificar o tumor como teratoma imaturo. Particularmente comuns são: um ‘estroma’ hipercelular e mitoticamente ativo que lembra o mesênquima embrionário; e elementos neuroectodérmicos primitivos com aparência semelhante à do neuroblastoma, com rosetas e canalículos lembrando tubo neural em desenvolvimento. Fendas forradas por neuroepitélio melanótico representam diferenciação retiniana abortiva. Fala-se em teratoma com transformação maligna quando o teratoma origina um câncer, mais freqüentemente um rabdomiossarcoma ou sarcoma indiferenciado, menos comumente um carcinoma epidermóide ou adenocarcinoma.
Tumor do saco vitelínico (ou tumor do seio endodérmico). É composto por células epiteliais primitivas representando o endoderma do saco vitelínico, situadas em uma matriz frouxa, mixóide e de celularidade variável, representando o mesoblasto extraembrionário. Microscopicamente, caracteriza-se por um padrão reticular (lace-like) de células cuboidais ou alongadas. Em cerca de 50% dos casos podem ser vistos os chamados seios endodérmicos: consistem de um centro mesodérmico com capilar central e camada visceral e parietal de células em volta, lembrando uma papila, ou um glomérulo primitivo (corpos de Schiller-Duval). Dentro e fora do citoplasma das células observam-se glóbulos de material hialino que são ricos de alfa-fetoproteína e alfa-1-antitripsina, demonstráveis por imunohistoquímica. A presença de AFP no componente epitelial do tumor do seio endodérmico é característica e ajuda no diagnóstico diferencial com germinoma e carcinoma embrionário.
Carcinoma embrionário. É composto por células grandes, com nucléolos evidentes, que proliferam formando ninhos coesos, massas, papilas abortivas, ou forrando espaços irregulares de tipo glandular. Há alta atividade mitótica e necrose coagulativa. As células expressam difusamente citoqueratinas, atestando diferenciação epitelial, o que o distingue dos germinomas. Porém, ambos apresentam imunoreatividade para PLAP.
Coriocarcinoma. Caracteriza-se por diferenciação extraembrionária ao longo de linhagens trofoblásticas. O diagnóstico requer elementos do cito- e do sinciciotrofoblasto. Estas últimas são células gigantes que freqüentemente são encontradas isoladamente em outros tumores germinativos, como o germinoma. O citotrofoblasto é composto por células grandes, mononucleadas, com núcleo vesiculoso, formando massas coesas. Os vasos estromais são canais ectasiados; há lagos vasculares e extensa necrose hemorrágica. As células do sinciciotrofoblasto se coram para b-HCG e HPL.
Etiologia. Há indícios de que gonadotrofinas podem ter papel na origem de tumores germinativos. Há preferência por pacientes peripuberais (início da adolescência), tendência a origem na vizinhança de núcleos diencefálicos que controlam atividade gonadotrófica, e associação com síndrome de Klinefelter. Nesta, os níveis séricos de gonadotrofinas estão cronicamente elevados. A síndrome se caracteriza por cariótipo 47 XXY, atrofia testicular, ginecomastia e hábito eunucóide. Estes pacientes estão também predispostos a tumores de células germinativas mediastinais e carcinomas mamários.
Citogenética. Anormalidades mais comuns em tumores de células germinativas gonadais e extragonadais são: ganhos no cromossomo X e anormalidades numéricas e estruturais nos cromossomos 12 e 1. Duplicação do braço curto do cromossomo 12 (isocromossomo 12p) é a anomalia mais comum em neoplasias de células germinativas no sexo masculino, encontrada em cerca de 80% dos tumores, independente da localização.
Histogênese. Não é compreendida. É possível que na vida embrionária células germinativas migrem do saco vitelínico para o SNC de forma aberrante, em vez de procurar as cristas genitais (genital ridges) em desenvolvimento. Contudo, nunca se demonstraram elementos germinativos no sistema nervoso normal, embrionário ou adulto. P. ex., foi feito um screening imunohistoquímico de glândulas pineais fetais para PLAP (placental-like alkaline phosphatase), que é um marcador de células germinativas primordiais. Nada foi encontrado.
Prognóstico. O fator mais importante é o tipo histológico. O germinoma puro tem o melhor prognóstico devido à sua alta radiosensibilidade, ao contrário do que ocorre com os outros tumores germinativos. A maioria dos pacientes com germinomas localizados podem ser curados com radioterapia. Sobrevida de 5 anos varia de 65 a 95%. Para os outros tumores germinativos, tudo depende de boa técnica cirúrgica. Teratomas maduros podem ser extirpados completamente por não serem invasivos. O outro fator importante é a extensão da doença quando do diagnóstico. Infiltração do hipotálamo, IIIº ventrículo e metástases às leptomeninges espinais pioram muito o prognóstico.
Fonte: Rosenblum MK, Ng HK: Germ Cell Tumours. in Kleihues P, Cavenee WK (eds), Tumours of the Nervous System. Pathology and Genetics. International Agency for Research on Cancer (IARC), Lyon, 1997.
Antonio Soares